

更新时间 2024-05-23 11:51:59
近日,由我国国家生物医学分析中心南湖实验室李慧艳、张宇程和周涛领衔的研究团队,在顶级期刊《细胞》上发表一项重磅研究成果[1]。
他们首次发现,起源于左侧胸椎第8–13背根神经节的痛觉神经元,会沿着血管在脾脏中蔓延,深入到B细胞所在区域;而且饮食中的辣椒素可以激活痛觉神经元,进而增强脾脏生发中心反应(特异性抗体产生等)和抗流感免疫力。
这一发现为通过靶向痛觉神经系统调节体液免疫提供了新思路。南湖实验室的吴敏、宋广平、李佳凝和宋增庆为论文共同第一作者。

▲ 论文首页截图
最近几年,神经免疫学是一个研究热点,而且出了很多重要的研究成果。
例如,早在2020年,清华大学和上海科技大学的研究人员就首次发现:中枢神经能直接调控脾脏(最大的次级淋巴器官)的体液免疫,并找到了背后的神经信号通路[2]。
在随后的4年里,陆续有研究发现外周神经中的自主神经(植物神经)也可以调节脾脏的免疫反应[3,4];然而,外周神经中的感觉神经是否可以调节脾脏的免疫反应仍未可知。
痛觉神经元是感觉神经元的重要组成部分,最近几年已经有研究发现痛觉神经元在调节免疫(尤其是T细胞免疫反应)中发挥着重要作用[5,6]。不过,痛觉神经元在B细胞反应和体液免疫中的潜在作用仍不为人知。
正是基于以上研究背景,李慧艳和她的同事们开始探索痛觉神经元与脾脏免疫反应之间的关系。
研究的第一步是判断脾脏中是否存在痛觉神经元。为了解决这个问题,研究人员采用了由德国组织工程和再生医学研究所团队推出的组织透明化技术——小胶束介导的人体器官透明化和标记(SHANEL)[7](这个酷炫的技术我们也介绍过,感兴趣的朋友可以点击蓝色文字跳转查看)。
在SHANEL的加持下,他们发现了痛觉神经特异性标志物降钙素基因相关肽(CGRP)的存在。随后,借助三维成像技术,他们发现脾脏内不仅存在痛觉神经元,而且这些神经元还构成了广泛而复杂的三维结构。
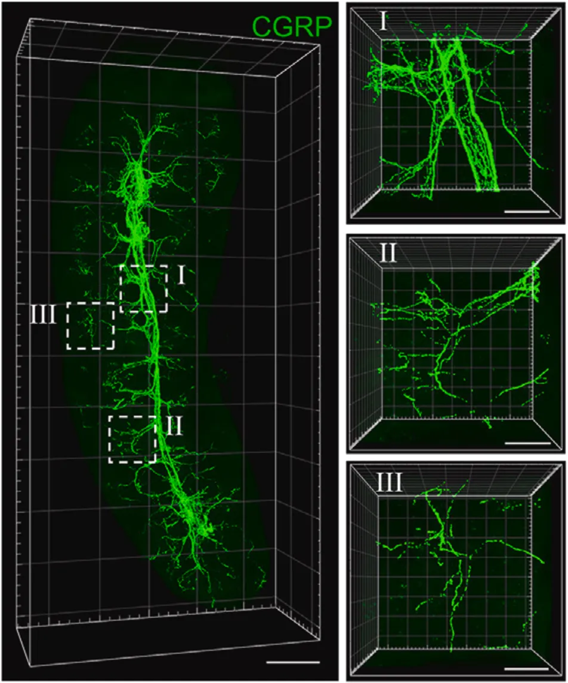
▲ 脾脏中痛觉神经元的空间结构
具体来说,CGRP阳性的痛觉神经从脾门进入脾实质,随后沿血管分支进入白髓。
在用B细胞标志物B220染色脾脏时,可发现B细胞区存在丰富的CGRP阳性痛觉神经,而且痛觉神经元与B细胞靠的非常近,似乎存在肢体接触。
这就意味着,痛觉神经元可能真的会调控脾脏的体液免疫。
随后,通过特异性清除CGRP阳性痛觉神经元,研究人员发现体液免疫反应减弱,证实了痛觉神经元对脾脏的生发中心反应和体液免疫至关重要。
至于脾脏中痛觉神经元的来源,研究人员将它们定位于左侧胸椎(脾脏同侧)第8–13(T8-T13)背根神经节。激活T8-T13背根神经节的痛觉感受器,可以增强脾脏的生发中心反应和特异性抗体水平。
在随后的机制研究中,研究人员发现,在病原物入侵之后,病原物的抗原被聚集在脾脏,会导致前列腺素E2(PGE2)等细胞因子的水平增加,而PGE2又可以激活痛觉神经元上的痛觉感受器,进一步促进降钙素基因相关肽(CGRP)的释放;接下来,CGRP会与B细胞上的异源二聚体受体CALCRL-RAMP1结合,并激活B细胞的cAMP信号通路,最终促进脾脏发生中心反应,增强体液免疫反应。
在研究的最后,李慧艳/张宇程/周涛团队探索了,让小鼠吃含辣椒素的辛辣食物是否可以激活痛觉神经元,进而增强小鼠的体液免疫,提高它们对流感的免疫力。
他们的实验结果显示,用含辣椒素的食物喂养的小鼠,在感染病毒之后,肺部的病毒载量和免疫细胞浸润水平显著降低。更重要的是,辣椒素能有效预防体重下降,并显著提高小鼠的存活率。在清除背根神经节之后,辣椒素的这种效果就消失了。
总的来说,李慧艳/张宇程/周涛团队这项研究揭示了脾脏中痛觉神经元的三维结构,以及痛觉神经元与脾脏体液免疫之间的关系。
由于脾脏是体液免疫的主要枢纽,这一发现对于通过靶向痛觉感受器调节体液免疫,进而防治病原物感染和自身免疫疾病有重要意义。尤其是研究还发现辣椒素可以直接增强宿主的免疫力,进一步提升了研究的转化价值。
关于好安森糖尿病治疗仪

好安森糖尿病治疗仪系出“人民健康家庭系统工程”,属于“四大系统工程”之一的“有序生命信息场工程”。好安森糖尿病治疗仪运用“钱学森系统学原理”,由好安森首席科学家何月蓉院士团队领衔科研攻关,倾尽心血打造,是“中医现代化”成果产品之一。
参考文献:
[1].Wu et al., Innervation of nociceptor neurons in the spleen promotes germinal center responses and humoral immunity, Cell. 2024. doi:10.1016/j.cell.2024.04.027
[2].Zhang X, Lei B, Yuan Y, et al. Brain control of humoral immune responses amenable to behavioural modulation. Nature. 2020;581(7807):204-208. doi:10.1038/s41586-020-2235-7
[3].Ulloa L. Bioelectronic neuro-immunology: Neuronal networks for sympathetic-splenic and vagal-adrenal control. Neuron. 2023;111(1):10-14. doi:10.1016/j.neuron.2022.09.015
[4].Zhu X, Huang JY, Dong WY, et al. Somatosensory cortex and central amygdala regulate neuropathic pain-mediated peripheral immune response via vagal projections to the spleen. Nat Neurosci. 2024;27(3):471-483. doi:10.1038/s41593-023-01561-8