

更新时间 2024-04-03 15:51:44
多发性硬化症(MS)是一种自身免疫性疾病,免疫系统攻击和破坏神经髓鞘,导致神经信号传导受损。病变边缘的骨髓细胞积聚,持续活化的髓系细胞是肿瘤坏死因子(TNF)、白细胞介素1β(IL-1β)、一氧化氮(NO)神经毒性因子的持续来源。

神经毒性因子导致髓鞘再生失败和继发性神经元/轴突损伤,还会导致发生脱髓鞘轴突中线粒体含量和活性增加等代偿反应,对患者的神经系统造成严重破坏,可能导致长期不可逆的功能障碍。
神经元线粒体复合物和能量代谢缺陷与持续的轴突损伤、灰质萎缩以及MS疾病进展有关,还在免疫反应中起到调剂作用。然而,在闷烧性炎症性中枢神经系统疾病的背景下,线粒体复合物在维持小胶质细胞活化中的作用尚未完全清楚。
来自剑桥大学的学者们采用多组学方法,确定了小胶质细胞中的线粒体复合物I通过维持小胶质细胞活化促进神经炎症的机制。阻断促炎小胶质细胞中的复合物I可以对中枢神经系统起到保护作用,改善动物疾病模型中的神经功能。研究发表在《自然》杂志上。
研究人员利用髓鞘少突胶质细胞糖蛋白肽35-55诱导了小鼠实验性自身免疫性脑脊髓炎(EAE)作为实验模型,并从急性EAE和慢性EAE小鼠脊髓中分离RFP+YFP+细胞(小胶质细胞)和RFP-YFP+细胞(主要由浸润性髓样细胞组成)。scRNA-seq数据显示,在急性EAE小鼠中,浸润性髓系细胞的流行率很高,而小胶质细胞在对照组和慢性EAE小鼠中占主导地位。
为了了解小胶质细胞在中枢神经系统疾病中的活化特征和动态,研究人员进行了聚类分析,并分析了RNA表达变化的速度和方向性。他们发现,小胶质细胞簇4在急性和慢性EAE中的状态相对保持一致,其活化状态与炎症相关基因的表达增加有关,线粒体复合物I(CI)亚基的基因表达在小胶质细胞簇4中进一步增加。
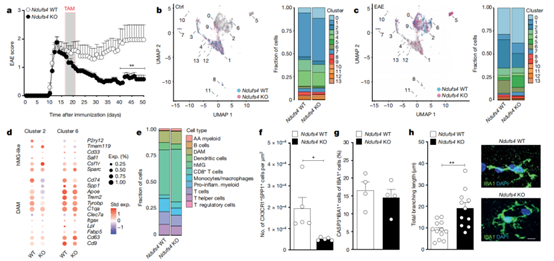
EAE小胶质细胞CI表达增加
液相色谱-质谱分析显示,急性EAE过渡至慢性EAE后,小胶质细胞表现出线粒体功能异常,包括CI-CII活性增加、ATP水平降低和线粒体膜电位升高,这可能是通过线粒体氧化应激反应途径实现的,使用CI抑制剂可以降低慢性EAE小胶质细胞ROS产生水平。
体外实验表明,抑制CI可以阻断促炎小胶质细胞中的逆向电子传递(RET),从而减少过量的线粒体ROS生成,保护神经元免受氧化应激损伤。小鼠实验也证明RET缺失会减轻神经炎症反应。
在急性EAE向慢性EAE的过渡期间,对小鼠骨髓细胞CI进行靶向抑制,可以观察到小鼠达到慢性EAE阶段时疾病程度显著降低,脊髓氧化应激水平显著降低,轴突丢失和变性减少。
接下来,研究人员使用小鼠和人类小胶质细胞进行了体外药物测试。CI抑制剂鱼藤酮和二甲双胍,CII抑制剂丙二酸二甲酯(DMM)和丙二酸二钠在体外显著降低ROS水平,CI和CII抑制剂组合可以进一步增强疗效。小鼠腹膜注射给药,经过筛选,DMM+二甲双胍可以在免疫30天后产生最佳治疗效果,小胶质细胞簇中的CI和CII表达显著减少,炎性小胶细胞数量减少,骨髓氧化应激水平降低。
总的来说,研究确定了EAE中的一个关键线粒体机制,通过维持小胶质细胞激活产生神经毒性损伤,促进中枢神经系统持续炎症。通过阻断CI或RET缺失的小胶质细胞可以阻断这一线粒体促炎通路。研究为治疗中枢神经系统的持续炎症提供了新的靶点,研究人员正在进行相关的临床试验,评估CI抑制剂二甲双胍对复发缓解型和进展型EAE患者的治疗效果。
关于好安森糖尿病治疗仪

好安森糖尿病治疗仪系出“人民健康家庭系统工程”,属于“四大系统工程”之一的“有序生命信息场工程”。好安森糖尿病治疗仪运用“钱学森系统学原理”,由好安森首席科学家何月蓉院士团队领衔科研攻关,倾尽心血打造,是“中医现代化”成果产品之一。
参考文献:
Peruzzotti-Jametti L, Willis C M, Krzak G, et al. Mitochondrial complex I activity in microglia sustains neuroinflammation[J]. Nature, 2024: 1-9.