

更新时间 2023-06-08 17:34:11
阿尔茨海默病(AD)是一种起病隐匿的进行性发展的神经退行性疾病。首要发病因素是年龄,尽管目前仍不清楚作用机制。众所周知,大脑中神经细胞周围的绝缘层,即髓鞘(myelin),会随着年龄增长而退化。
近期,德国马克斯-普朗克 多学科科学研究所在Nature期刊上发布了论文标题为“Myelin dysfunction drives amyloid-β deposition in models of Alzheimer’s disease”的研究发现,这种有缺陷的髓鞘会积极促进阿尔茨海默病的疾病相关变化。减缓与年龄有关的髓鞘损伤可能为预防这种疾病或推迟它未来的进展开辟新途径。

我当时要做什么?我把钥匙放在哪里了?那个约会又是什么时候?它开始时是轻微的记忆缺失,随后是越来越多的问题,如辨别方向、跟随对话、表达或执行简单的任务。在最后阶段,患者往往需要依赖他人照顾。阿尔茨海默病是逐步进展的,主要影响老年人。65岁以后,患阿尔茨海默病的风险每5年增加一倍。

大脑中的衰老迹象
马克斯-普朗克 多学科科学研究所所长Klaus-Armin Nave说,“解释年龄和阿尔茨海默病之间相关性的基本机制还没有被阐明。”他与他的神经遗传学系团队一起,研究髓鞘---大脑神经细胞纤维的富含脂质的绝缘层---的功能。髓鞘确保了神经细胞之间的快速沟通,并支持它们的代谢。Nave说,“完整的髓鞘对正常的大脑功能至为关键。我们发现与年龄有关的髓鞘变化会促进阿尔茨海默病的病理变化。”

在这项新的研究中,这些作者探讨了与年龄有关的髓鞘退化在阿尔茨海默病发展中的可能作用。他们的研究重点是这种疾病的一个典型特征。
论文共同第一作者Constanze Depp说,“阿尔茨海默病的特点是某些蛋白在大脑中的沉积,即所谓的Aβ肽。Aβ肽聚集在一起,形成淀粉样斑块。在阿尔茨海默病患者中,这些斑块在这种疾病的首批症状出现之前的许多年,甚至几十年就已经形成。”在该疾病的过程中,神经细胞最终不可逆转地死亡,大脑中的信息传输受到干扰。
利用成像和生化方法,这些作者研究并比较了不同的阿尔茨海默病小鼠模型,在这些模型中,淀粉样斑块的发生方式与阿尔茨海默病患者相似。然而,他们首次研究了还具有髓鞘缺陷的阿尔茨海默病小鼠模型,这种缺陷也会发生在人类老年时的大脑中。
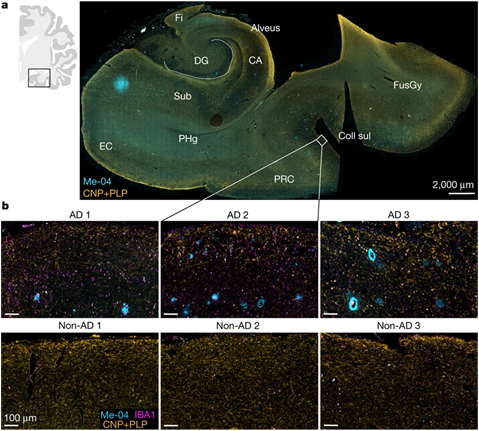
△阿尔茨海默病患者的髓磷脂损伤。图片来自Nature, 2023, doi:10.1038/s41586-023-06120-6
论文共同第一作者Ting Sun描述了他们的研究结果:“我们观察到,髓鞘的退化加速了小鼠大脑中淀粉样斑块的沉积。有缺陷的髓鞘给神经纤维带来压力,导致它们膨胀并产生更多的Aβ肽”。
免疫细胞不堪重负
Depp补充说,“与此同时,髓鞘缺陷吸引了大脑中称为小胶质细胞的免疫细胞的注意。这些细胞非常警觉,监测大脑的任何损伤迹象。它们可以拾取并摧毁物质,如死细胞或细胞成分。”
正常情况下,小胶质细胞检测并消除淀粉样蛋白斑块,阻止它们聚集在一起。然而,当小胶质细胞同时面对有缺陷的髓鞘和淀粉样斑块时,它们主要是清除髓鞘的残余物,而淀粉样斑块则继续累积。这些作者猜测,小胶质细胞被髓鞘损伤“分心”,因而无法对淀粉样斑块作出适当反应。
Nave说,“这项新的研究首次发现衰老的大脑中的髓鞘缺陷会增加Aβ肽沉积的风险。我们希望这将导致新的治疗方法。如果我们成功地减缓了与年龄有关的髓鞘损伤,这也可能预防或减缓阿尔茨海默病。”
关于好安森糖尿病治疗仪

好安森糖尿病治疗仪系出“人民健康家庭系统工程”,属于“四大系统工程”之一的“有序生命信息场工程”。好安森糖尿病治疗仪运用“钱学森系统学原理”,由好安森首席科学家何月蓉院士团队领衔科研攻关,倾尽心血打造,是“中医现代化”成果产品之一。
参考资料:
Constanze Depp et al. Myelin dysfunction drives amyloid-β deposition in models of Alzheimer's disease. Nature, 2023, doi:10.1038/s41586-023-06120-6.