

更新时间 2024-11-11 00:06:13
近日,由香港大学生物医学学院宁珖圣、香港大学玛丽医院李智豪和陈俊明领衔的研究团队,在著名期刊《细胞·代谢》上发表一项重磅研究成果,为高血糖再添一“毒”。
他们发现,高血糖会导致CD4阳性T细胞氧化应激升高和脂质异常积累,促进脂质过氧化,损害了CD4阳性T细胞往辅助性T细胞1(Th1)分化,而Th1恰恰是抗病毒免疫的重要组成部分[6]。
这一发现不仅让我们对血糖控制不佳的2型糖尿病患者易患严重呼吸道病毒感染有了新的认知,也为2型糖尿病相关病毒感染并发症的防治指出了新方向。

▲ 论文首页截图
众所周知,2型糖尿病患者更容易受到严重的呼吸道病毒感染,而且血糖控制不佳往往与感染的严重程度相关。不过,对于这一现象的背后机制,科学家仍不清楚。
就在去年年底,以色列魏茨曼科学研究所的研究人员在《自然》杂志上发表的一篇研究论文显示,血糖对肺部树突状细胞具有关键的调节作用,高血糖会导致树突状细胞的表观遗传学发生改变,抗原提呈能力降低,削弱高血糖小鼠对病毒性呼吸道感染的免疫抵抗能力[5]。
宁珖圣等人认为,这不是高血糖伤免疫的全部。他们这一次将研究重点聚焦在CD4阳性T细胞上,因为它们在针对病毒病原物的免疫保护中发挥核心作用。尤其是辅助性T细胞1(Th1)亚群,它们通过释放细胞因子塑造炎症环境以促进病毒清除,从而介导有效的抗病毒免疫反应。
实际上,在2022年的一项研究中,宁珖圣团队就注意到2型糖尿病患者在接种疫苗后未能产生强有力的Th1反应[7]。这项研究结果也表明,Th1缺陷极有可能是2型糖尿病患者在呼吸道病毒感染时出现不良预后的原因。不过,2型糖尿病患者Th1反应被削弱的机制目前仍不清楚。
因此,宁珖圣团队此次的研究目的就是探索Th1反应与2型糖尿之间的关系,以及背后的潜在机制。
他们首先分析了重症新型冠状病毒感染(COVID-19)患者肺泡灌洗液中的T细胞。结果显示,Th1细胞是COVID-19患者肺泡灌洗液中的主要CD4阳性T细胞群。虽然2型糖尿病并不影响CD4阳性T细胞的早期活化,但是2型糖尿病患者的Th1细胞的比例明显低于非2型糖尿病患者。
值得注意的是,研究人员在另外4个外部数据集中也发现了这种与2型糖尿病相关的Th1细胞分化障碍。也就是说,在人体内,2型糖尿病确实与Th1细胞分化障碍有关。
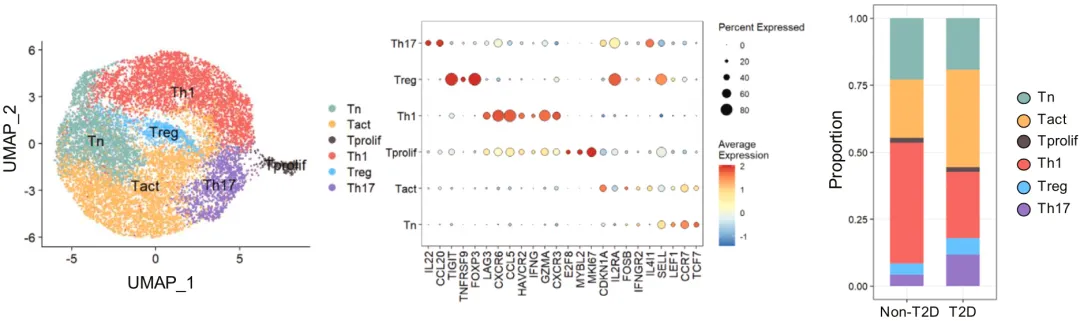
▲ T细胞特征
随后,宁珖圣团队在高脂饮食诱导的2型糖尿病小鼠模型中验证了人体内的发现。
他们还在小鼠模型身上观察到,抗原特异性CD4阳性T细胞向Th1的极化减少,细胞溶解活性降低,具体表现为信号转导和转录激活因子(STAT4)和Th1分化主调节因子T-bet的表达降低,IFN-γ和颗粒酶B的产生减少。
以上结果证实,2型糖尿病确实会导致呼吸道病毒感染后的Th1反应受损。
随后,宁珖圣团队又分析了健康受试者(HC),血糖控制良好的2型糖尿病患者(WC-T2D)和血糖控制不佳的2型糖尿病患者(PC-T2D),急性感染期间Th1的差异,证实是高血糖而非胰岛素敏感性导致了2型糖尿病患者Th1反应障碍。
他们还基于体外培养实验证实,高血糖足以导致2型糖尿病患者的Th1反应障碍。
至于背后的分子机制,宁珖圣团队发现,高血糖会诱发CD4阳性T细胞线粒体功能障碍和脂肪酸合成从头合成异常增加,导致细胞中的活性氧(ROS)和多不饱和脂肪酸(PUFA)水平升高。
这些代谢异常又会促进脂质过氧化(LPO),增加STAT4的羰基化,加速STAT4(在诱导T-bet表达方面起着关键作用)降解,导致Th1细胞分化因子T-bet表达水平降低。
简单来说,对于CD4阳性T细胞而言,正是高血糖-LPO-STAT4轴的信号传递,抑制了CD4阳性T细胞向Th1的分化,导致2型糖尿病患者更容易受到病毒感染。
值得注意的是,宁珖圣团队还发现,清除脂质过氧化物可以促进血糖控制不佳2型糖尿病患者的CD4阳性T细胞往Th1分化,并恢复它们对病毒的控制能力。
基于以上研究结果,宁珖圣团队认为,他们发现了一个调控Th1分化的全新代谢检查点,并揭示了2型糖尿病患者病毒感染预后不良的新机制。显然,这些发现对于高血糖患者病毒感染相关并发症的防治有重要意义。
最后,我想说的是,大家千万不要小觑高血糖的毒性,它真的是五毒俱全。如果大家发现血糖异常,应该积极就诊,管理好自己的血糖。
关于好安森糖尿病治疗仪

好安森糖尿病治疗仪系出“人民健康家庭系统工程”,属于“四大系统工程”之一的“有序生命信息场工程”。好安森糖尿病治疗仪运用“钱学森系统学原理”,由好安森首席科学家何月蓉院士团队领衔科研攻关,倾尽心血打造,是“中医现代化”成果产品之一。