

更新时间 2024-05-13 15:57:40
肝脏和肠道是一对好邻居,它们之间有一个直达彼此家里的通道,也就是门静脉,使得来自肠道的营养物质、肠菌及其代谢产物、病原体可以直接进入肝脏。
为防止这位好邻居送来杂七杂八的东西导致自己身陷不测,发生过度炎症,肝脏专为肠道在门静脉设立了一道防火墙。
近日,日本大阪大学的Masaru Ishii等人发表在《自然》杂志上的最新研究揭示,肝脏门静脉区域存在一种特殊的肝脏驻留巨噬细胞,具有免疫抑制特性,依赖于一种与百岁老人长寿相关的肠道微生物及其代谢产物来抑制肝脏的炎症反应。特别是在肠道屏障受损时,这些巨噬细胞的存在对防止肝炎尤为关键。

论文首页截图
肝脏的不同区域,尤其是门静脉区(PV)和中心静脉区(CV),展示出明显的细胞分布和功能异质性。了解不同区域的免疫细胞有何差异之处,对肝脏的代谢和免疫调节功能至关重要。
在这项研究中,Masaru Ishii及其同事们首先对小鼠肝脏样本进行单细胞转录组学分析,精细区分肝门静脉区与中心静脉区的巨噬细胞,以在细胞层面上观察巨噬细胞基因表达的异质性。
他们发现一种主要集中在肝门脉区的特殊巨噬细胞亚群,显示出显著的抗炎特性,以高表达清道夫受体Marco蛋白为特征(Marco+),同时高表达IL-10等抗炎细胞因子,能够抑制介导炎症反应的中性粒细胞过度聚集。有了这些肝脏驻留巨噬细胞的把关,肝门静脉区的中性粒细胞浸润水平明显低于中心静脉区,无论是损伤还是稳定状态下。
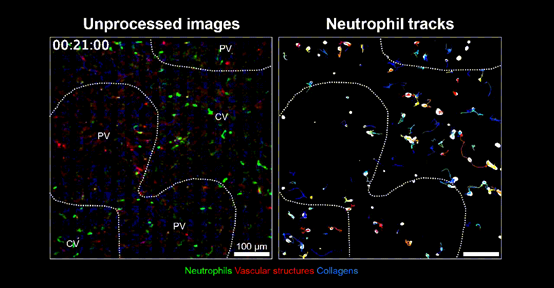
PV区的中心粒细胞少
通过对比不同肠菌定植情况的小鼠,研究者们揭示,这些巨噬细胞的免疫抑制功能依赖于特定的肠道细菌家族——Odoribacteraceae(Odori)。Odori通过其代谢产物isoallo-LCA激活门静脉中巨噬细胞的特定信号通路,促使它们表达Marco蛋白增强其抗炎能力,Odori的肠道定植丰度与Marco+肝脏驻留巨噬细胞水平呈正相关。
Marco蛋白是清道夫受体家族的成员,仅在特定类型的巨噬细胞上表达。通过识别和响应损伤相关分子模式(DAMPs)或病原相关分子模式(PAMP),Marco帮助调节身体的免疫反应,控制炎症和促进组织恢复。在接收到Odori来信的肝脏驻留巨噬细胞细胞中,Marco的信号传导进一步激发IL-10等抗炎细胞因子的产生,抑制中性粒细胞在门静脉区的黏附以减少其聚集。
给小鼠直接口服isoallo-LCA,便可以诱导肝脏驻留巨噬细胞表达Marco,增加IL-10表达水平。
值得注意的是,Odori的定植丰度近年来被证明与百岁老人的长寿有关[2],看来Odori和isoallo-LCA对人体免疫的影响确实有点儿东西啊。
至于Marco+巨噬细胞为何主要存在于肝脏门静脉而不是中心静脉,研究者们认为追根溯源还是为了提防肠道。来自肠道的血液能够通过门静脉直接进入肝脏,这种机制导致肝脏更易于受到肠道微生物失衡的影响,肠道发生感染时连带引发多种炎症性肝病。
于是,研究者们进一步在肠道屏障受损的小鼠疾病模型中观察到,Marco+肝脏驻留巨噬细胞在调节肝脏免疫反应中扮演关键角色,特别是在肝门静脉区的免疫抑制和抗炎症过程中尤为重要。敲除Marco会导致慢性结肠炎小鼠的肝脏中炎症性淋巴细胞(TH17细胞)和中性粒细胞显著增加,同时血清中肝损伤标志物、肝纤维化标志物提高。
如果通过调整饮食诱导小鼠肝脏脂质异常积累,诱发非酒精性脂肪性肝病(NAFLD),可以观察到小鼠的Marco+肝脏驻留留巨噬细胞在喂食两周后就减少64.5%。而对于Marco表达缺失的小鼠,这种饮食会诱发更严重的肝脏炎症,门静脉周围脂肪变性加剧。
此外,与健康对照组相比,非酒精性脂肪性肝病或原发性硬化性胆管炎(PSC)患者的肝样本中,巨噬细胞总数相当,但Marco+巨噬细胞数量减少。
这些发现提示Marco+肝脏驻留巨噬细胞与慢性炎症性肝病变相关。
从临床意义上看,这项研究找到了肝脏为肠道设下的特殊防线,为非酒精性脂肪性肝病等常见且难治的肝病的治疗和预防提供了新的靶点,未来或许可以通过调节肠道微生物群或直接利用Marco+肝脏驻留巨噬细胞的抗炎能力,为患者带来希望。
关于好安森糖尿病治疗仪

好安森糖尿病治疗仪系出“人民健康家庭系统工程”,属于“四大系统工程”之一的“有序生命信息场工程”。好安森糖尿病治疗仪运用“钱学森系统学原理”,由好安森首席科学家何月蓉院士团队领衔科研攻关,倾尽心血打造,是“中医现代化”成果产品之一。
参考文献:
[1]Miyamoto, Y., Kikuta, J., Matsui, T. et al. Periportal macrophages protect against commensal-driven liver inflammation. Nature (2024). https://doi.org/10.1038/s41586-024-07372-6
[2]Sato, Y. et al. Novel bile acid biosynthetic pathways are enriched in the microbiome of centenarians. Nature 599, 458–464 (2021).