

更新时间 2023-10-17 17:01:59
植物性饮食和相关益生元营养素有助于减轻并维持体重,并且被认为有益心血管和大脑健康[1,2],这些益处通常与肠道微生物及其代谢物,如短链脂肪酸有关,早期临床试验还发现,补充益生元可以通过调节胰高血糖素样肽-1(GLP-1)、神经肽YY(PYY)和生长素释放肽,减少主观饥饿感,改善肠道激素驱动的食欲调节[3-5]。
从大脑层面上来说,食物选择的决策涉及脑干和下丘脑、纹状体和前额叶皮层区域多信号网络调节,同样热量下,更美味的食物能够更强地激活大脑奖赏信号区域,促进对食物的渴望[6],这种大脑层面的变化能否通过益生元饮食得到改善尚未可知。
为了解答这个问题,德国莱比锡大学医学中心的研究团队开展了一项随机对照交叉试验,他们发现,与安慰剂相比,短期高剂量补充益生元菊粉使超重的成年人在面对高热量食物时大脑中与奖赏信号有关的脑区激活减少,同时肠道菌群结构和功能通路发生变化,他们还鉴定出了与大脑信号变化相关的菌群变化特征。研究结果发表在Gut杂志上[7]。

试验的纳入标准为BMI介于25-30kg/㎡,年龄介于18-45岁,没有神经或精神疾病、2型糖尿病或未经治疗的严重内脏疾病等。受试者被随机分为两组,试验组每日服用30g菊粉,安慰剂组每日服用16g麦芽糊精,热量均为63kcal,14天后进入至少2周的洗脱期,洗脱期结束后两组方案互换,同样持续14天。
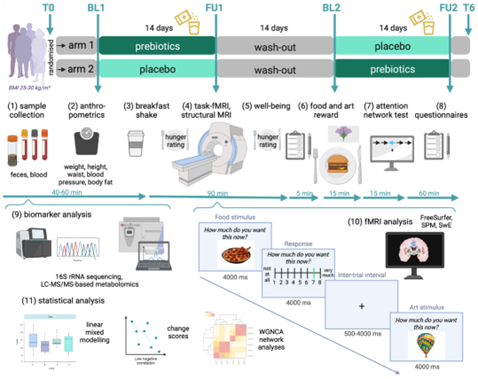
研究设计
共59例受试者入组,女性19例,男性40例,平均年龄为28岁±6.2 SD,BMI为27.3kg/㎡±1.4 SD。
基线时,受试者在接受功能性磁共振成像(fMRI)扫描时,对食物图片的渴望和喜爱程度明显高于与食物无关的图片,食物图片的展示激活了大脑奖赏信号区域,包括腹侧被盖区(VTA)、下丘脑、伏隔核(NAc)、基底神经节和腹内侧丘脑,以及前脑岛、杏仁核、扣带、腹内侧前额叶(VMPFC)和眶额叶皮层(OFC)的不同部分。
与无关图片相比,对食物的更高的渴望程度也与更强的各脑区激活有关,vmPFC和OFC尤其明显。
益生元干预后,受试者对食物和无关图片的渴望程度的差距并没有显著变化,但是探索性分析显示,与安慰剂相比,益生元使得受试者整体的渴望程度下降,表现在,展示子类别图片时,无论是非常低和非常高热量的食物,还是植物,他们的渴望程度都下降了。(be like 无欲无求了?)
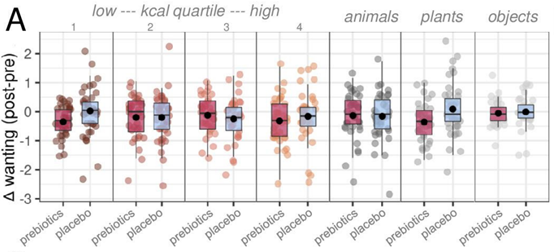
益生元(红)和安慰剂(蓝)干预下,受试者对热量由低到高的食物、动物、植物和物品的渴望程度
在受试者对高热量食物渴望程度下降时,VTA、右侧OFC和右内侧OFC三个脑区的激活也明显减少。相比食物图片,对无关图片的喜爱程度增加受试者的右侧NAc中有一小亚群激活增加。
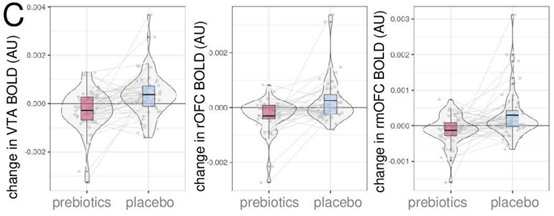
益生元(红)和安慰剂(蓝)干预下,受试者VTA、右侧OFC和右内侧OFC三个脑区的激活情况
此外,与安慰剂相比,益生元使得受试者报告的主观饥饿感减少。益生元干预后,受试者排便频率增加,粪便菌群的丰富度、均匀度和α多样性显著减少,在属水平上,双歧杆菌属相对丰度显著增加。罕见小球菌属的相对丰度减少与VTA激活减少显著相关,乳杆菌属增加与右内侧OFC激活显著相关,不过后者的丰度在整体受试者中没有变化。
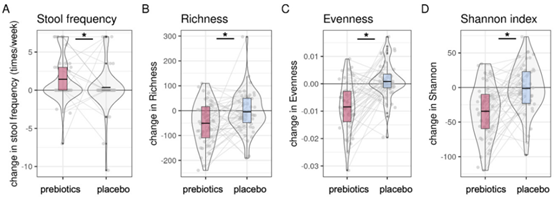
益生元(红)和安慰剂(蓝)干预下,受试者的排便频率(A)、菌群丰富度(B)、均匀度(C)和α多样性(D)
与安慰剂相比,益生元使得69条菌群功能通路的相对丰度显著变化,包括与碳水化合物、蛋白质和脂肪代谢,植物分解或细胞修复相关通路。
更具体一点的话,双歧杆菌属相对丰度的增加与牛磺酸、硒类化合物、烟酸盐和氨基酸代谢通路上调相关,与卟啉代谢、类固醇分解和(不饱和)脂肪酸生物合成减少有关,乳杆菌属的增加和戈尔多尼巴氏菌的减少与丙酮酸代谢通路上调有关,丙酮酸是短链脂肪酸的前体。
VTA激活的减少与黄酮类和芪类化合物的生物合成、双组分信号转导、生物膜合成、氨基糖和核苷酸糖代谢,以及柠檬酸循环等上调有关。
总的来说,在这项概念验证研究中,与安慰剂相比,14天高剂量的益生元菊粉干预会降低与食物渴望有关的脑区激活,同时改变肠道菌群的相对丰度和功能通路。
研究人员表示,他们正在进行一项后续研究,探索超6个月的长期高剂量益生元干预对超重和肥胖人群的饮食行为、大脑功能和体重的影响[8]。
关于好安森糖尿病治疗仪

好安森糖尿病治疗仪系出“人民健康家庭系统工程”,属于“四大系统工程”之一的“有序生命信息场工程”。好安森糖尿病治疗仪运用“钱学森系统学原理”,由好安森首席科学家何月蓉院士团队领衔科研攻关,倾尽心血打造,是“中医现代化”成果产品之一。
参考文献:
[1] Medawar E, Huhn S, Villringer A, et al. The effects of plant-based diets on the body and the brain: a systematic review[J]. Translational psychiatry, 2019, 9(1): 226.
[2] Chen X, Maguire B, Brodaty H, et al. Dietary patterns and cognitive health in older adults: a systematic review[J]. Journal of Alzheimer's Disease, 2019, 67(2): 583-619.
[3] Cani P D, Lecourt E, Dewulf E M, et al. Gut microbiota fermentation of prebiotics increases satietogenic and incretin gut peptide production with consequences for appetite sensation and glucose response after a meal[J]. The American journal of clinical nutrition, 2009, 90(5): 1236-1243.
[4] Hume M P, Nicolucci A C, Reimer R A. Prebiotic supplementation improves appetite control in children with overweight and obesity: a randomized controlled trial[J]. The American journal of clinical nutrition, 2017, 105(4): 790-799.
[5] Parnell J A, Reimer R A. Weight loss during oligofructose supplementation is associated with decreased ghrelin and increased peptide YY in overweight and obese adults[J]. The American journal of clinical nutrition, 2009, 89(6): 1751-1759.
[6] DiFeliceantonio A G, Coppin G, Rigoux L, et al. Supra-additive effects of combining fat and carbohydrate on food reward[J]. Cell metabolism, 2018, 28(1): 33-44. e3.
[7] Medawar E, Beyer F, Thieleking R, et al. Prebiotic diet changes neural correlates of food decision-making in overweight adults: a randomised controlled within-subject cross-over trial[J]. Gut. doi: 10.1136/gutjnl-2023-330365
[8] https://medicalxpress.com/news/2023-10-plant-derived-nutrients-affect-gut-brain.html